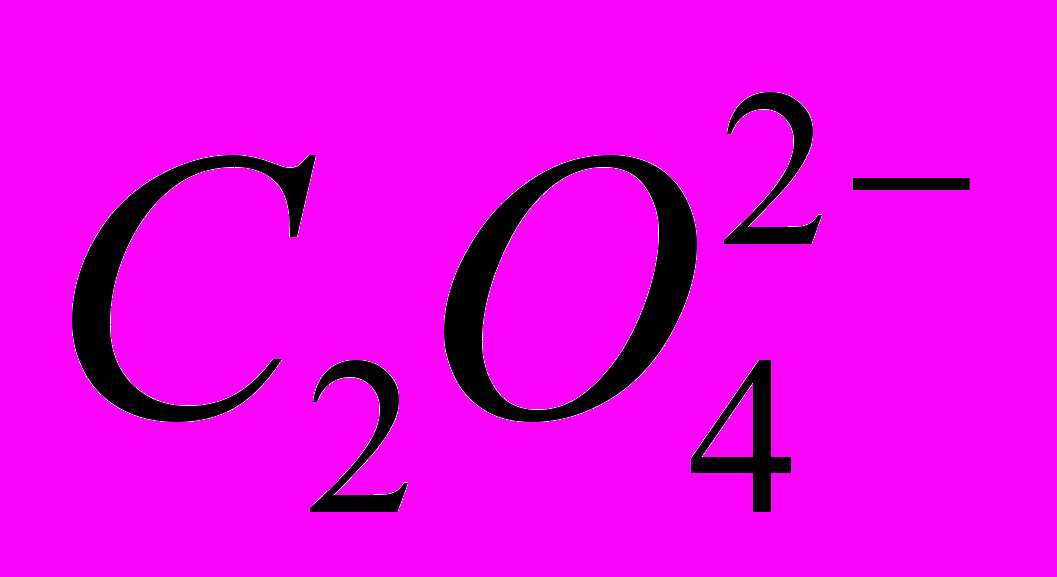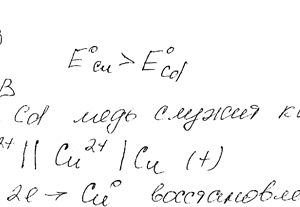Медь не вытесняет водород из разбавленных кислот Почему Однако если к медной пластинке
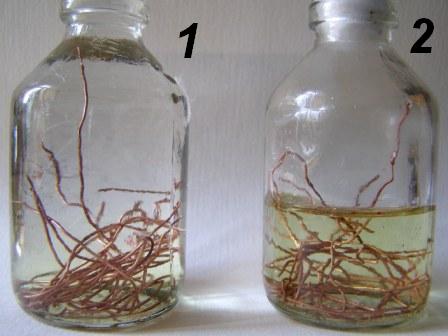
Медь не вытесняет водород из разбавленных кислот. Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов.




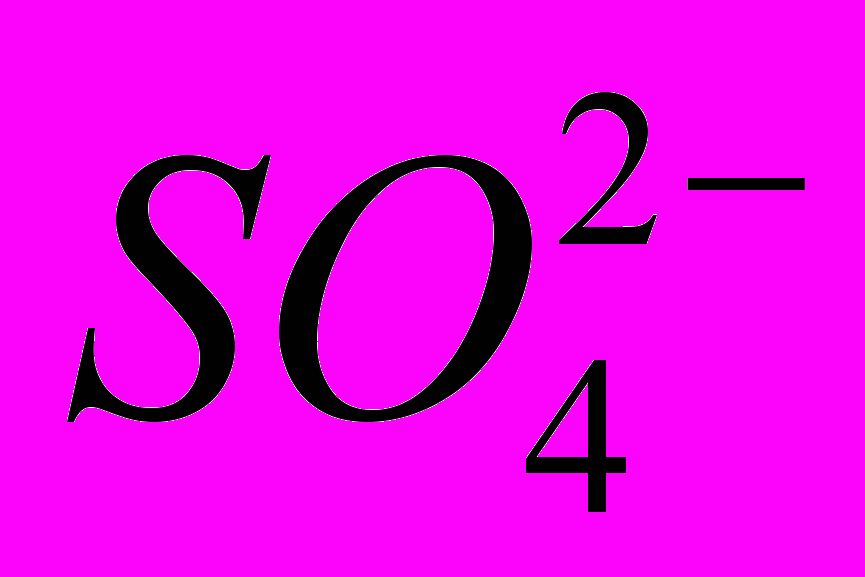





Запомнить меня. Пароль должен быть длиной не менее ти символов. Чтобы сделать его безопаснее, используйте заглавные и строчные буквы, цифры и символы, такие как! Медь не вытесняет водород из разбавленных кислот. Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода.










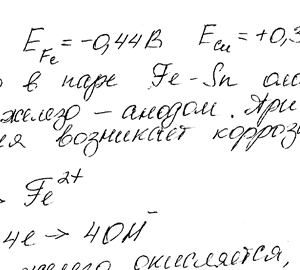
Ответ, казалось бы, очевиден: в любом учебнике написано, что медь не растворяется в соляной кислоте. Объясняют это просто: металлы, которые расположены в электрохимическом ряду напряжений правее водорода, не могут вытеснять его из кислот. Другими словами, если анион кислоты не проявляет окислительных свойств, медь в таких кислотах растворяться не должна.